DualFluo™ Firefly/Renilla Luciferase Dual Assay Kits

- 产品货号: D201 咨询
- 产品规格: 20 T/100 T/10×100 T
- 目录价(元): 343/1326/7427
| 产品介绍 |
报告基因是一种与表达载体中启动子序列或元件相连的外源编码区,它被导入细胞内,为测量启动子活性提供了有效方法。当报告基因在细胞中表达后,可通过直接检测报告基因蛋白,或者评估其酶活性来实现对报告基因的检测,进而将融合启动子元件的强度与报告基因的表达量建立关联。常见的报告基因类型,除了萤光素酶类,还有荧光蛋白类(如GFP、RFP)和酶活性类(如β半乳糖苷酶)。
萤火虫萤光素酶(Firefly Luciferase)在ATP、Mg²⁺和氧气同时存在时,会催化萤光素(Luciferin)氧化,生成氧化萤光素(Oxyluciferin),在这一过程中会发出波长约560nm的生物萤光,以此来检测萤火虫萤光素酶。海肾萤光素酶则在氧气存在条件下,催化腔肠素(Coelenterazine)氧化为腔肠酰胺(Coelenteramide),氧化时发出波长约480nm的生物萤光,用于检测海肾萤光素酶。这两种萤光都属于化学发光,可利用酶标仪的化学发光检测模块进行测定,具体检测原理见下图。
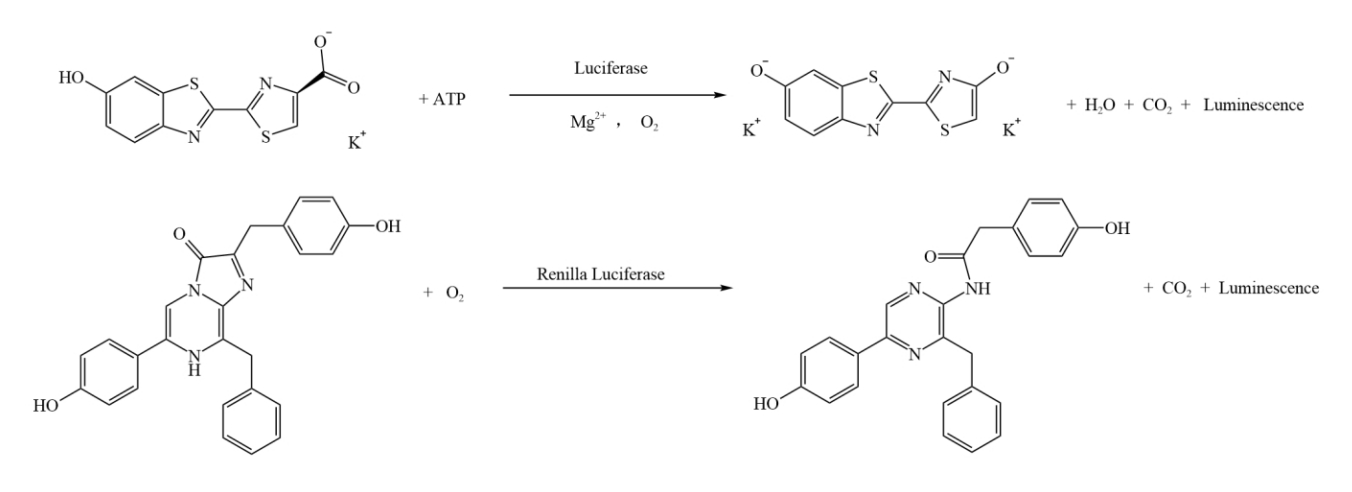
萤火虫和海肾萤光素酶检测原理图 本试剂盒基于上述两种发光体系,先以萤光素为底物,检测萤火虫萤光素酶报告基因的活性,在淬灭该萤光反应的同时,再以腔肠素为底物,检测海肾萤光素酶报告基因的活性。 |
||||||||||||||||||||||||
| 应用范围 | 启动子、增强子、转录因子活性研究、miRNA 靶向研究、信号通路研究、蛋白质相互作用、核受体研究、活化剂或抑制剂的影响等。 | ||||||||||||||||||||||||
| 保存条件 | -20℃ 避光保存;冰袋运输。 | ||||||||||||||||||||||||
| 产品组分 |
注:(1) E组分具有较强的挥发性,开封使用后,务必及时拧紧盖子,并使用封口膜严密密封,以防挥发,确保保存效果。 (2) 当使用B组分将C组分配制成工作液后,要避免对其进行反复冻融。倘若单次使用量较少,建议将其分装后,存放于-20℃的冰箱中保存。 |
||||||||||||||||||||||||
| 注意事项 |
1. 在开展实验前,请先对产品进行瞬时离心操作,使内容物沉降至管底,再进行后续步骤。2. 萤火虫萤光素酶所催化生物发光的最强波长处于560nm,海肾萤光素酶催化生物发光的最强波长则是480nm 。检测时,请采用化学发光(Luminescence)模块进行操作。3. 海肾萤光素酶检测工作液配制完成后,建议即刻使用,以确保最佳检测效果。若因特殊情况无法马上使用,可将其存储于 -20ºC 的环境中,但其保存期限仅为一周。随着保存时长增加,检测灵敏度和准确性会逐步降低,所以,为避免对实验结果产生不利影响,请勿将其配制成工作液后长期存放。4. 酶促反应受温度影响较大,在加样检测前,务必将所有试剂放置室温环境(20 - 25℃),待其温度平衡后再使用。5. 为有效避免孔间干扰,推荐使用白色不透光孔板。黑色不透光孔板也能够用于实验,但与白色不透光板相比,使用黑色板测得的荧光值会偏低。6. 本实验需自行准备 PBS 试剂,若是处理植物样本,还需提前准备好研钵、研磨棒、磁珠以及液氮。7. 本产品仅限于科研用途并且不得存放于普通住宅内。8. 为了您的安全和健康,请遵循您所在常规实验室安全规定。 |
1. 问:C 组分的颜色到底是无色还是黄绿色?
答:本底物是我们公司自主合成的,不同批次间存在批间差,这是正常现象。
2. 问:为什么试剂盒使用到最后,发现 E 组分不够?
答:E 组的溶剂是易挥发的有机溶剂,为了减少 E 组分的挥发,请每次使用完毕后尽快密封并放至 -20 ℃ 保存。
3. 问:酶标仪的检测设置?
答:Luminescence,350~700 nm,建议检测时间设为 2~10 s。请注意是发光(Lum)模块不是吸光度 (Abs) 板块。
4. 问:检测使用的板子应该怎么选择?
答:为防止孔间干扰,建议使用白色不透光孔板。黑色不透光孔板也可使用,但相较于白色不透光板测得的萤光值会低。
5. 问:双报告基因表达载体应该怎么选择?
答:(1) 选择萤火虫报告基因质粒时,理论上,只要含有 luc 基因的质粒都能作为萤火虫报告基因质粒。但不同实验对载体的要求存在差异,如果计划自行构建载体,须留意部分载体是没有启动子的,像 pGL3 Basic,这种情况下就需要自行插入启动子,才能确保基因正常表达。
(2) 在挑选海肾报告基因质粒时,尽量选用带有中等强度启动子的,例如TK启动子。不能选择像CMV、SV40这类强启动子。海肾基因的表达活性要明显高于背景组,同时不能对萤火虫萤光素酶报告基因的表达产生干扰,这样才能保证实验结果的准确性和可靠性。
(3) 报告基因表达载体可选择策略分为两种。双载体共转染:可以选择分别携带萤火虫萤光素酶报告基因和海肾萤光素酶报告基因的两个表达载体进行共转染。若将海肾萤光素酶作为内对照来构建对照载体,那么萤火虫萤光素酶则作为实验组构建实验载体。在共转染时,实验载体与对照载体的比例在10︰1到100︰1之间(甚至更大比例也可行),具体比例可根据实验情况通过预实验来确定。
单载体选择:也可以选择一个特殊的表达质粒,该质粒能够同时表达萤火虫萤光素酶和海肾萤光素酶,不过二者的表达分别由不同的启动子控制。这种情况下,选择表达量相对较弱的作为内对照,以此来平衡实验体系,使实验结果更具说服力 。
6. 问:怎么保证数据重复性和复孔误差?
答:(1)为取得最佳测定效果,在使用具有化学发光测定功能的多功能荧光酶标仪时,宜先把样品全部加好,然后用排枪统一加入萤火虫萤光素酶检测试剂;用单管的化学发光仪测定时,样品和测定试剂混合后到测定前的时间应尽量控制一致。
(2)细胞裂解后建议离心取上清进行检测,确保样品的均一性。
(3)由于温度对酶促反应影响较为明显,所以测定时,样品和试剂均需达到室温后再进行测定。
7. 问:荧光值过高是什么原因造成的?该怎么解决?
答:(1) 荧光值过高可能会超出仪器检测范围,从而检测不到值。
(2) 减少质粒转染量。
(3) 细胞样品裂解后,离心取上清后检测或对裂解产物进行稀释后检测。
(4) 不建议通过减少底物量来降低荧光值,需要保证底物的饱和来反映荧光素酶真实的表达水平,否则会造成检测结果出现大的偏差。
8. 问:荧光值过低或无荧光值是什么原因造成的?该怎么解决?
答:(1) 荧光素酶的表达水平与启动子活性相关,正常表达水平下检测到的荧光值应在 105 数量级左右,若检测到的荧光值比较低或无荧光值,可从优化细胞培养条件和更换强启动子活性等方面进行考虑。
1)转染后的细胞培养使用特异性诱导启动子的条件;
2) 优化细胞的培养条件,提高荧光素酶的表达量;
3) 更换强启动子(如 SV40、CMV)。
4) 海肾荧光素酶基因作为内对照,其表达应不受时期、部位、环境影响,因此常用组成型表达的 TK 启动子。
(2) 转染效率低。
1) 优化转染实验条件,用较易转染的质粒做阳性对照(如转染过表达荧光蛋白质粒);
2) 确保转染 DNA 的质量,可通过酶切或琼脂糖凝胶电泳的方法对 DNA 质量进行鉴定;
3) 选择活性较高,处于指数分裂期的细胞进行转染。
(3) 样品裂解效率低。
1) 细胞培养时间不宜过长,12~36 h 内最好,长时间培养后,细胞可能会难裂解。
2) 加入的裂解液需足量,保证细胞能够充分裂解。
(4) 检测过程操作不规范。
1) 选择合适的检测仪器,能够检测化学发光或者生物发光的仪器都适用于该实验;
2) 需加入足量底物,保证底物的饱和,否则会造成检测结果出现很大偏差;
3) 室温反应。反应时各个组分(细胞裂解产物,底物工作液等)都需要调整到室温;
4) 荧光素酶的半衰期一般约 30 min,加完底物后可立即检测,尽量在 30 min 内完成。
(5) 底物氧化失效。
1) 底物避光密封保存,萤火虫萤光素酶底物 -20 ℃ 保存;海肾萤光素酶底物推荐 -20 ℃ 保存;
2) 反应工作液建议现用现配。
9. 问:裂解液稀释可以用DEPC水稀释吗?
答:不建议使用DEPC水稀释的,DEPC水中含有RNA酶抑制剂可能会对其他酶有干扰,最好使用灭菌的双蒸水配置裂解液。
10. 问:如何判断实验体系无异常?
答:(1)对照的两个实验组,即实验组1与实验组2 Luc表达情况应无显著差异;
(2)转染正常,质粒确保成功转染入细胞;
(3)Luc检测值在仪器检测线性范围内。
11. 问:如何判断转染成功?
答:(1)如果转入的miRNA带荧光标记如GFP,则可直接在转染后、细胞裂解前,显微镜下观察细胞荧光;
(2)设置一个荧光质粒转染参照组,同批转染一个组的细胞,间接反映同批次实验的转染情况。
12. 问:细胞密度对实验有何影响?
答:细胞密度不均匀会导致转染效率不一致,影响萤光素酶表达量。铺板时要保证细胞均匀分布,选择合适的细胞密度进行转染,一般40%-80%汇合度为宜。
13. 问:质粒比例如何确定?
答:萤火虫载体与海肾载体比例可通过预实验确定,如分别尝试1:10、1:20、1:50、1:100等比例,选择萤火虫萤光素酶检测发光值大于海肾萤光素酶发光值的比例,保证检测的准确性与稳定性。
